System monitorowania niepożądanych działań leków nie funkcjonuje prawidłowo. Działania te rozpoznawane w szpitalach, nie zawsze są jednak zgłaszane przez pracowników medycznych do odpowiednich organów. Zaniechania te nie pozwalają na dokładne poznanie zagrożeń towarzyszących farmakoterapii, a w konsekwencji na ograniczanie niektórych niekorzystnych następstw stosowania leków.
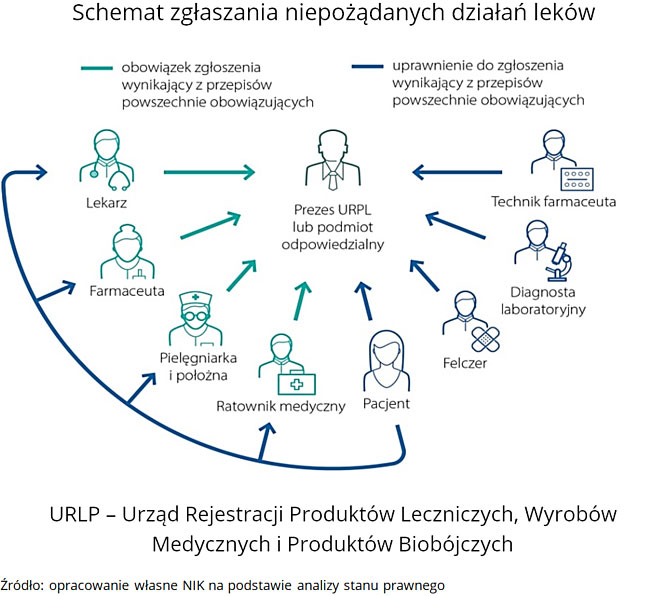
Bez przekazania informacji o działaniu niepożądanym związanym ze stosowaniem produktu leczniczego nie ma szans, by system nadzoru nad bezpieczeństwem farmakoterapii spełnił swoje zadanie. Nadzór ten, prowadzony globalnie oraz indywidualnie w poszczególnych krajach, jest ważnym elementem systemów opieki zdrowotnej na całym świecie.
W całej Unii Europejskiej uznane zostało, że działaniem niepożądanym produktu leczniczego (ndl) jest każde niekorzystne i niezamierzone działanie produktu leczniczego. Tymczasem w niektórych szpitalach definicja ndl jest zawężana, przez co wykluczane są następstwa stosowania leków przed przyjęciem do szpitala lub w dawkach innych niż terapeutyczne.
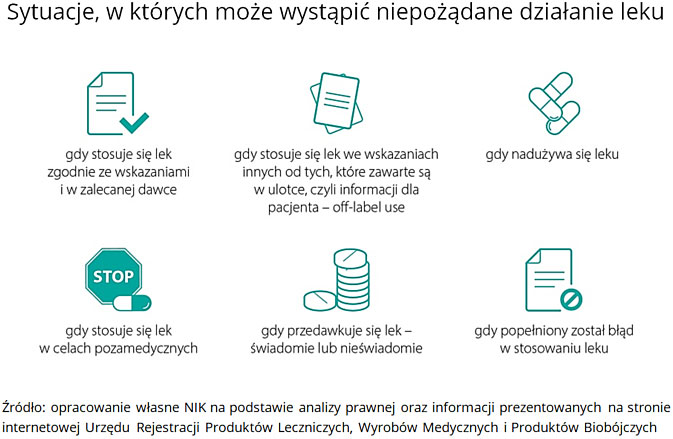
Już we wcześniejszych kontrolach prowadzonych w latach 2016-2019, NIK stwierdziła, że zgłoszeń ndl nie przekazywano do właściwych instytucji oraz do aptek szpitalnych lub przekazywano je ze znacznym opóźnieniem.
W trakcie obecnej kontroli monitorowania ndl stwierdzono, że żaden ze skontrolowanych szpitali nie zadbał o prawidłowe funkcjonowanie systemu wychwytywania, zgłaszania i analizowania niepożądanych działań leków. Aż w 30% kontrolowanych szpitali personel medyczny nie stwierdził żadnego ndl, a w 20% szpitali liczba ndl stwierdzonych przez personel medyczny w okresie trzech lat wahała się od dwóch do ośmiu przypadków.
Zgłoszenia niepożądanych działań leków (ndl), w tym niepożądanych odczynów poszczepiennych (nop), winny trafiać do właściwego urzędu lub podmiotu odpowiedzialnego. Zarówno URLP, jak i podmioty odpowiedzialne zobowiązane są do dokonania analiz przyczynowo-skutkowych otrzymanych zgłoszeń i przekazania ich do zewnętrznych baz danych. W Polsce działają też w ramach uczelni wyższych w Krakowie, Poznaniu, Wrocławiu, Szczecinie i Gdańsku regionalne ośrodki monitorowania ndl. Chociaż są one niezależne od Urzędu i nie są formalnie włączone do systemu zgłaszania ndl, to gromadzą i analizują dane o ndl, a także prowadzą działalność informacyjno-szkoleniową dla pracowników ochrony zdrowia w zakresie zgłaszania ndl.
W sytuacji, gdy pracownicy medyczni nie uznawali niepożądanych reakcji polekowych za ndl, chociaż zapisy w dokumentacji medycznej na to wskazywały, to organy właściwe do ich monitorowania nie wiedziały o ich występowaniu. To osłabiało system.
Problem zbyt niskiego odsetka zdiagnozowanych i zgłaszanych ndl w odniesieniu do rzeczywistej ich liczby podnoszony był przez przedstawicieli środowisk lekarskich oraz ekspertów w dziedzinie bezpieczeństwa farmakoterapii – również w trakcie panelu zorganizowanego w NIK w lutym 2020 r. W spotkaniu udział wzięli przedstawiciele Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Narodowego Funduszu Zdrowia, Rzecznika Praw Pacjenta, środowisk naukowych, samorządu aptekarskiego oraz stowarzyszeń, których przedmiot działalności wiąże się z bezpieczeństwem stosowania leków. W toku dyskusji jednoznacznie potwierdzona została prawidłowość kwestionowania przez NIK sytuacji niezgłaszania do Urzędu wszelkich niekorzystnych następstw stosowania leków.
Zgłoszenia ndl pochodzą najczęściej od lekarzy, a personel pielęgniarski i ratowniczy nie jest aktywny w tym zakresie. Ustalenia kontroli oraz wyniki badań ankietowych 840 respondentów pokazują także, iż zdarzają się sytuacje, w których osoby wykonujące zawody medyczne błędnie interpretują definicję ndl, nie znają jej lub nie stosują.
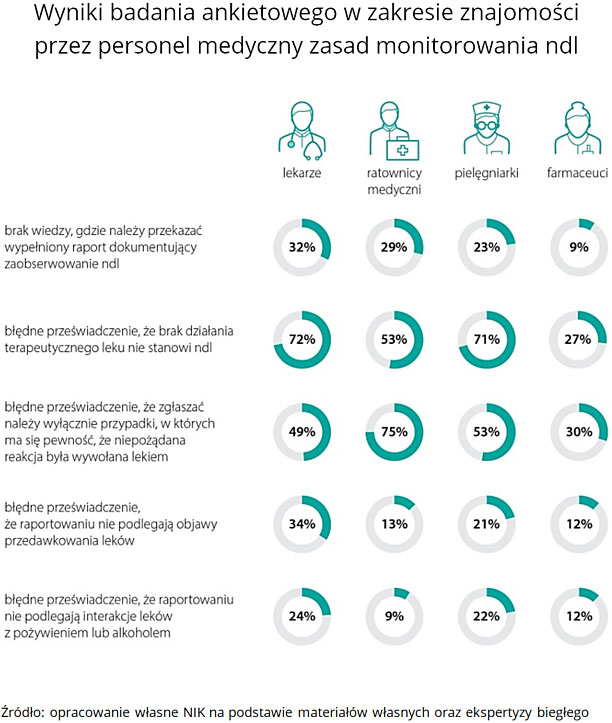
W ponad 300 przypadkach (z 1190 analizowanych przez NIK) personel medyczny nie uznał negatywnych skutków działania leków za ndl, mimo że spełnione zostały przesłanki do takiej kwalifikacji. Z tego aż 85% przypadków, zgodnie z ustawową definicją, powinno zostać uznanych za ciężkie ndl, ponieważ spowodowały one konieczność hospitalizacji. Wg ustaleń NIK liczba zgłoszeń ndl w kontrolowanych jednostkach powinna być co najmniej dwukrotnie wyższa niż to faktycznie miało miejsce. W rezultacie duża część niepożądanych działań leków nie zostaje zgłoszona lub zostaje błędnie sklasyfikowana (działanie „nieciężkie” zamiast „ciężkie”).
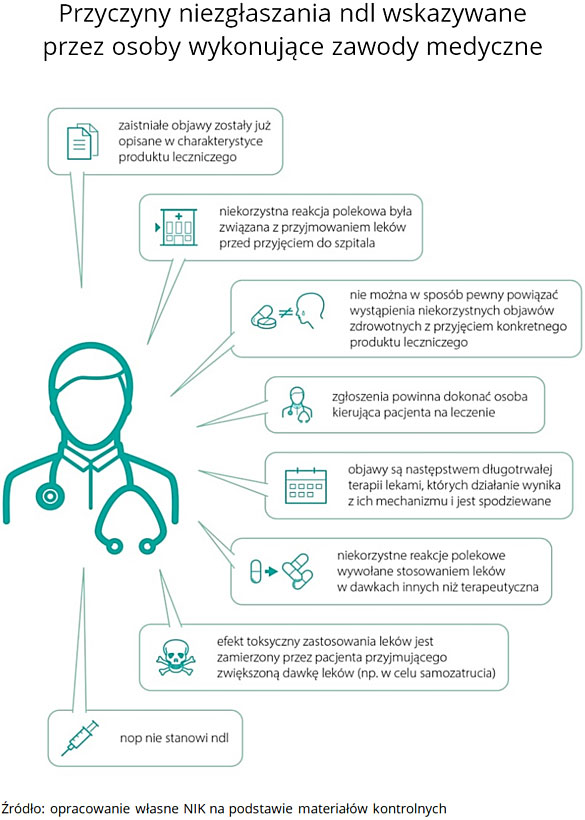
Niemal połowa ndl stwierdzonych przez pracowników medycznych w kontrolowanych szpitalach nie została w ogóle zgłoszona do urzędu lub podmiotu odpowiedzialnego bądź została zgłoszona z opóźnieniem przekraczającym ustawowe 15 dni.
W żadnym szpitalu nie stworzono warunków do prawidłowej realizacji obowiązków w zakresie zgłaszania ndl przez osoby wykonujące zawody medyczne. Nie ma w nich bowiem nadzoru nad identyfikowaniem ndl i ich zgłaszaniem, nie prowadzi się też w wystarczającym zakresie akcji informacyjno-edukacyjnych – akcje takie stwierdzono w ¾ szpitali, ale w ograniczonym zakresie i dla zawężonego kręgu pracowników. Udział aptek szpitalnych w monitorowaniu ndl jest ograniczony, a lekarze nie przekazują do nich informacji o ich wystąpieniu.
Obowiązek zgłaszania ndl spoczywa tylko na pracownikach medycznych, a same placówki nie mają obowiązku przekazywać tych zgłoszeń dalej – stanowi to istotną barierę w egzekwowaniu realizacji tego obowiązku w szpitalach.
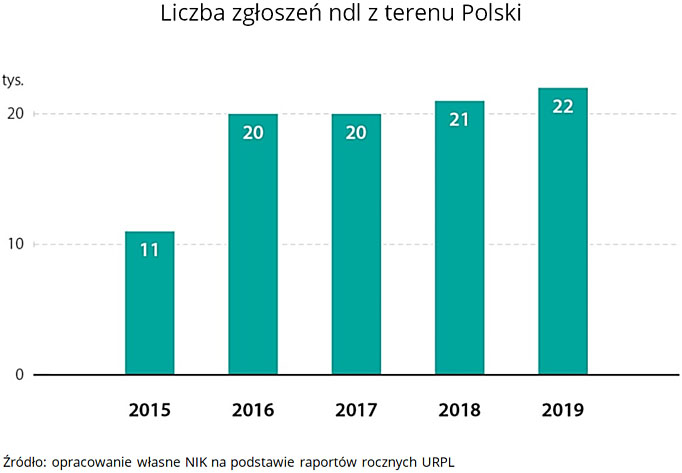
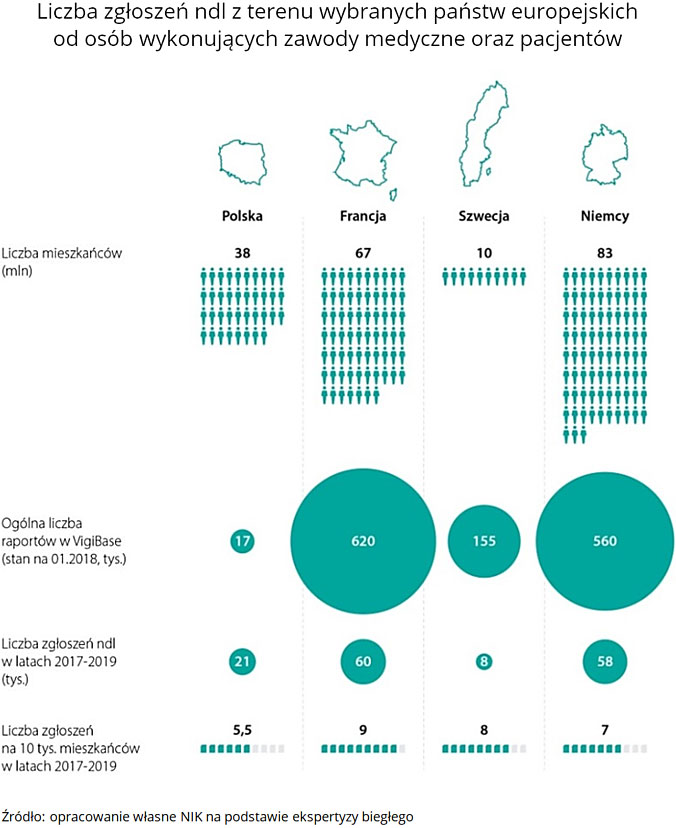
Dane uzyskane przez powołanego w toku kontroli biegłego wskazują, że lekarze w Polsce kierują o ponad połowę mniej zgłoszeń ndl, niż można się spodziewać. Biorąc po uwagę: liczbę lekarzy, ludności i produktów leczniczych – oczekuje się rocznego zgłaszania ndl na poziomie około 45 000 raportów, w rzeczywistości wynosi ono od 19 996 do 21 696 rocznie (dane z lat 2017-2019).
Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczychrzetelnie realizował część zadań w zakresie nadzoru nad bezpieczeństwem farmakoterapii – kierował stosowne komunikaty nt. bezpieczeństwa stosowania produktu leczniczego, działał na rzecz aktywizacji osób zobowiązanych lub uprawnionych do informowania o wystąpieniu ndl. Niedomagał monitoring ndl, czego przejawem były przede wszystkim wieloletnie zaległości Urzędu w prowadzeniu analiz przyczynowo-skutkowych zgłoszeń i przekazywanie zgłoszeń do zewnętrznych baz danych. Urząd ograniczył stan zaległości w analizie wpływających do niego zgłoszeń ndl sięgających pierwotnie do czterech lat. Jednak zaległości w przekazywaniu zgłoszeń do zewnętrznych baz danych zwiększyły się w badanym okresie z prawie 7 tys. zgłoszeń do niemal 19 tys.
Tym samym bardzo ważne dane o ew. szkodliwości stosowania pewnych leków nie docierały lub docierały z opóźnieniem do instytucji odpowiedzialnych za monitorowanie bezpieczeństwa leków w skali europejskiej i światowej, a w konsekwencji do producentów leków i personelu medycznego.

NIK wskazuje, że zaległości w przekazywaniu danych związane były m.in. z brakami kadrowymi w Urzędzie. Prezes Urzędu ogłaszał kolejne nabory, jednak nie przyniosły one spodziewanych rezultatów. Informował także ministra zdrowia o potrzebie zwiększenia zatrudnienia w urzędzie w związku z wejściem w życie nowych obowiązków wynikających z regulacji prawnych. Tymczasem zapewnienie skuteczności systemu monitorowania ndl uzależnione jest od wzmocnienia organizacyjnego urzędu. Jest to szczególnie istotne, bowiem wraz ze wzrostem świadomości osób zobowiązanych i uprawnionych do zgłaszania ndl, problemy z realizacją zadań statutowych związanych z monitorowaniem niekorzystnych reakcji polekowych mogą się pogłębiać.
Wnioski
Wnioski generalne do ministra zdrowia
Najwyższa Izba Kontroli, na podstawie ustaleń kontroli, zwróciła się do ministra zdrowia o podjęcie działań w celu:
- przeprowadzenia rzetelnej analizy potrzeb finansowych urzędu niezbędnych dla zapewnienia prawidłowej realizacji obowiązków związanych z analizą i przekazywaniem zgłoszeń ndl,
- zwiększenia udziału w procesie nauczania przyszłych lekarzy i innych osób wykonujących zawody medyczne zagadnień związanych z ndl oraz stałego podnoszenia kwalifikacji w tym zakresie.
Wnioski de lege ferenda do ministra zdrowia
Rozwiązania prawne odnoszące się do problematyki monitorowania niekorzystnych reakcji polekowych nie stwarzały warunków do prawidłowego przepływu informacji o występowaniu ndl. Dlatego Najwyższa Izba Kontroli skierowała do ministra zdrowia również wniosek o rozważenie:
- zmiany prawa poprzez wprowadzenie obowiązku odnotowywania w dokumentacji medycznej wystąpienia ndl ze wskazaniem kategorii, do której ono należy;
Dokumentowanie wystąpienia ndl i odnotowywanie faktu jego wystąpienia przez osoby wykonujące zawody medyczne jest niezbędne dla prawidłowego monitorowania bezpieczeństwa farmakoterapii.
Wprowadzona zmiana pozwoli na:
- prowadzenie nadzoru nad realizacją przez osoby wykonujące zawody medyczne obowiązków wynikających z przepisów szczególnych, co do zgłaszania takich działań;
- określenie, czy wybrany proces leczniczy wiązać się może z wystąpieniem ndl;
- optymalizację decyzji podejmowanych przez osoby wykonujące zawody medyczne, które posiadając szersze spektrum informacji o stanie zdrowia lub sposobie funkcjonowania pacjenta, będą mogły w sposób kompleksowy rozważyć potencjalne korzyści i zagrożenia proponowanych rozwiązań terapeutycznych.
- podjęcia działań legislacyjnych mających na celu wprowadzenia w przepisach powszechnie obowiązujących definicji pojęcia „monitorowanie niepożądanych działań leków”.
Wskazany w art. 86 ust. 3 pkt 7 ustawy Prawo farmaceutyczne udział w monitorowaniu działań niepożądanych leków interpretowany jest niejednolicie przez osoby odpowiedzialne za funkcjonowanie szpitali. Realizacja tej usługi farmaceutycznej polega niekiedy na ograniczeniu zadań kierownika apteki szpitalnej do ewidencjonowania i przekazywania zgłoszeń ndl do urzędu lub podmiotu odpowiedzialnego.
Wnioski systemowe do dyrektorów szpitali
W związku z ustaleniami kontroli przeprowadzonej w szpitalach NIK wnosi o:
- zapewnienie skutecznego nadzoru nad monitorowaniem ndl, w tym nad identyfikowaniem i klasyfikowaniem przez osoby wykonujące zawody medyczne niekorzystnych reakcji polekowych i ich terminowym zgłaszaniem, a także nad prawidłową i rzetelną realizacją obowiązków wynikających z procedur wewnętrznych dotyczących ndl;
- zapewnienie zgłaszania stwierdzonych u pacjentów szpitala ndl do prezesa Urzędu lub podmiotu odpowiedzialnego oraz aptek szpitalnych z zachowaniem obowiązujących terminów oraz ich ewidencjonowanie;
- zapewnienie aptekom szpitalnym udziału w monitorowaniu ndl;
- podjęcie lub zintensyfikowanie działań informacyjno-edukacyjnych skierowanych do osób wykonujących zawody medyczne, obejmujących zagadnienia monitorowania i zgłaszania ndl.
źródło: NIK
fot. Adobe Stock

